近年、次世代CAR-T療法「PRIME-CAR-T」が固形がん治療の新たな希望として注目されています。CAR-T(キメラ抗原受容体T細胞)療法は患者自身のT細胞(免疫細胞)を遺伝子改変しがんを攻撃させる先端的治療法ですが、従来は主に血液がんで成功を収めてきました。一方で固形がんに対しては、腫瘍へのT細胞浸潤の困難さや腫瘍の不均一性(異なる抗原を持つがん細胞の混在)といった課題により、有効な治療法確立が難航していました。こうした課題を克服すべく登場したのがPRIME-CAR-T療法です。本記事では、PRIME-CAR-Tの特徴と従来型CAR-Tとの違い、現在までの有効性・安全性エビデンス、承認・保険適用の見通し、さらには医療経済的な影響について、最新情報に基づき解説します。
PRIME-CAR-T療法の特徴と従来CAR-Tとの違い
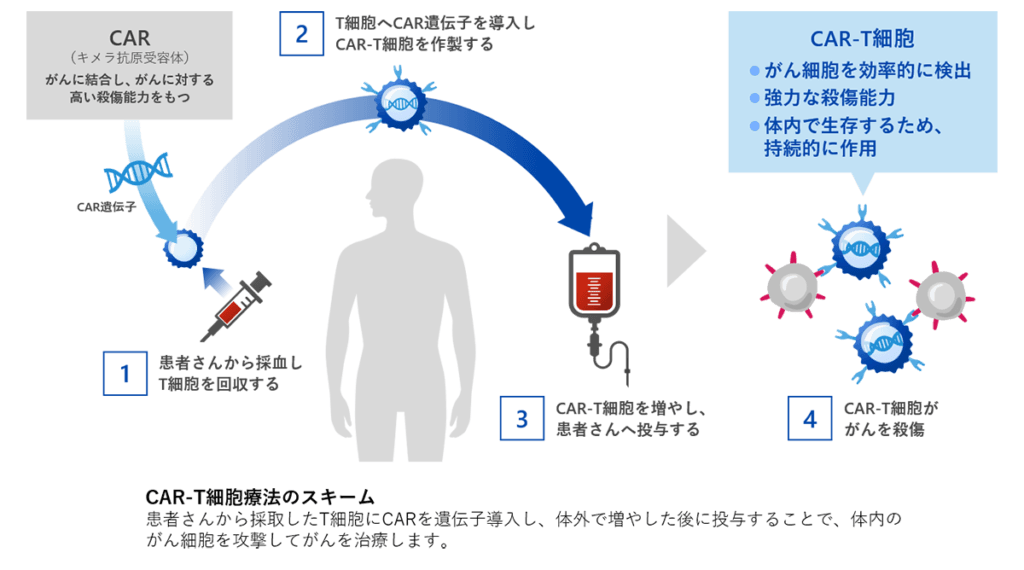
従来型CAR-T療法は患者から採取したT細胞にがん抗原を認識する人工受容体(CAR遺伝子)を導入し、体外で増幅して体内に戻すことで、特定の抗原を持つがん細胞を攻撃させる治療法です。血液がん(白血病・リンパ腫)では画期的な効果を示しましたが、固形がんでは十分な効果が得られていません。
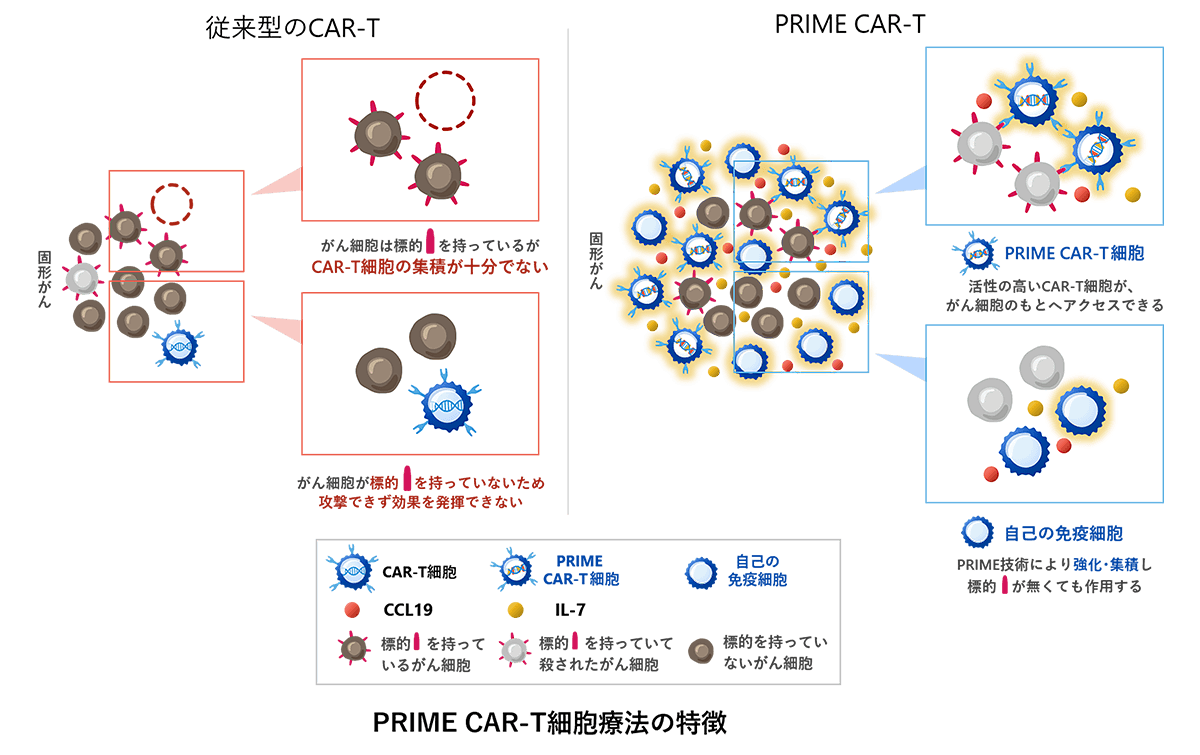
最大の理由は、CAR-T細胞が固形腫瘍の組織内に十分行き渡らないことと、CAR-Tが標的とする抗原を持たないがん細胞には効果が及ばないことです。固形腫瘍は血液がんと異なり局所に塊を形成し、内部は免疫細胞が入り込みにくい「免疫抑制環境」となっています。また、一つの腫瘍内でも抗原の発現が一様でなく、一部の細胞はCAR-Tの標的から逃れて生き残る可能性があります。
こうした課題に対処するため開発されたのがPRIME-CAR-T(プライムCAR-T)です。「PRIME(Proliferation-Inducing and Migration-Enhancing)」とは「増殖誘導および遊走促進」という意味で、その名の通りCAR-T細胞自身にサイトカインとケモカイン(免疫細胞を引き寄せる物質)を作らせる次世代型のCAR-T技術です。
具体的には、CAR-T細胞がインターロイキン7(IL-7)とCCL19という2つの因子を同時に産生するよう遺伝子改変されています。IL-7はT細胞の増殖・生存を促進するサイトカインであり、CCL19はリンパ組織でT細胞や樹状細胞を呼び寄せるケモカインです。
これにより、PRIME-CAR-T細胞が腫瘍内部で自分自身や周囲の免疫細胞(他のT細胞や樹状細胞など)の増殖・集積を促し、まるでリンパ節内のT細胞集積エリア(T-cell zone)が腫瘍内に形成されるような環境を作り出すことが狙いです。結果として、より多くの免疫細胞が腫瘍に集まり、抗原陰性のがん細胞も含めて幅広く攻撃できる可能性があります。
有効性と安全性に関するエビデンス
PRIME-CAR-T療法の有効性は、まず前臨床研究で明らかにされました。2018年のNature Biotechnology誌に掲載された基礎研究では、IL-7とCCL19を分泌するCAR-T細胞(7×19 CAR-T細胞とも呼ばれる)がマウスの固形がんモデルにおいて、従来型CAR-Tよりも腫瘍組織内への高い浸潤能と強力な抗腫瘍効果を示しました。
さらに一度このCAR-T治療で腫瘍消失に成功したマウスでは、標的抗原を持たない同系統の腫瘍細胞を再度移植しても再発を長期にわたり抑制できたと報告されています。これは、PRIME-CAR-T療法が腫瘍に対する免疫記憶の獲得や“抗原スプレッディング”※による広範な免疫応答を引き起こし、抗原陰性のがん細胞にも対処できた可能性を示唆しています。
※抗原スプレッディング: 初期の免疫反応で標的とした抗原以外の腫瘍抗原にも免疫が及ぶ現象のこと。
その後、臨床段階でも徐々にエビデンスが蓄積しつつあります。血液がん領域では、中国において難治性の大型B細胞リンパ腫(R/R LBCL)患者を対象にCD19標的の7×19型CAR-T細胞を投与する第1相試験が行われました。
最新の報告では、全奏効率79.5%(完全寛解56.4%)という高い奏効率が示され、無増悪生存期間中央値は13か月、2年全生存率も53.8%に達しました。副作用プロファイルも良好で、重篤なサイトカイン放出症候群(CRSグレード3以上)は12.8%、神経毒性(ICANSグレード3以上)は10.3%にとどまり、従来のCAR-T療法と比べて安全性が向上した可能性があります。このように7×19 CAR-T細胞はこれまで報告された従来型CAR-Tを上回る有効性と良好な安全性を示したと評価されており、難治性B細胞リンパ腫に対する有望な新戦略と位置付けられています。
固形がん領域でも臨床試験の成果が現れ始めています。ノイルイミューン社のパイプラインであるGPC3(グリピカン3)標的PRIME-CAR-T細胞(製品コードNIB102、Takeda社でのコードTAK-102)は、肝細胞がんなどGPC3陽性の固形がん患者を対象に第1相試験が実施されました。
2024年に発表された同試験結果によると、投与用量は1×10^7〜5×10^8細胞まで段階的に増やしつつ安全性評価が行われ、用量制限毒性(DLT)はいずれの用量でも発現せず、また重篤な神経毒性(ICANS)は一例も生じませんでした。一部高用量群で軽度のCRSが6例見られたものの、いずれも適切に対処可能な範囲であり概ね許容できる安全性が確認されています。
効果の面では、対象患者11名中、肝細胞がんの1名において約6か月にわたる腫瘍縮小の持続効果が認められ、一定の抗腫瘍活性の証拠も示されました。ただし初期試験の症例数が少なく、他の患者では明確な腫瘍縮小は限定的であったため、これらの結果は慎重に解釈する必要があります。全体として、固形がんへのPRIME-CAR-T療法も安全性は良好で、手がかりとなる有効性の兆候が示唆された段階と言え、今後の追加臨床試験で効果検証が求められます。
承認と保険適用の見通し(日本および海外)
承認状況について、2025年現在、PRIME-CAR-T療法を含むIL-7/CCL19産生型の次世代CAR-T製剤は、日本を含め世界でまだ正式承認された製品はありません。しかし各国で開発が加速しており、少なくとも4件の臨床試験が国内外で進行中または完了しています。たとえば前述の中国におけるリンパ腫対象試験(NCT04381741など)や、多発性骨髄腫を対象とした類似コンセプトの試験、日本国内でもノイルイミューン社/武田薬品のGPC3-CAR-T試験(NCT04405778)が行われました。
開発企業との提携も活発で、中外製薬(ロシュ傘下)は2022年にノイルイミューン社のPRIME技術のライセンス契約を締結し、固形腫瘍領域へのCAR-T応用に乗り出しています。また、中国のLegend Biotech社、米国のAdaptimmune社など海外企業もノイルイミューン社と協業し、自社の細胞療法にPRIME技術を組み込む取り組みを進めています。
こうした動きから、数年以内に本格的な第II相/第III相試験が実施され、早ければ後半の2020年代に承認申請が行われる可能性もあります。特に中国ではCAR-T療法の開発・承認が活発であり、7×19型CAR-Tのリンパ腫治療についても有望な結果次第では自国承認に向けた動きが加速する可能性があります。
一方、日本においても、仮に臨床試験で顕著な有効性が確認されれば希少疾病用製剤の指定や条件付き早期承認制度などの活用によって2020年代終盤〜2030年前後の承認が視野に入るでしょう。ただし現時点では治験段階であり、実際の承認取得までには更なる大規模臨床試験で有効性・安全性を確認する必要があります。
保険適用の見通しについては、CAR-T療法が承認された際の各国の対応を踏まえると、PRIME-CAR-T療法も承認後は公的医療保険の適用を受ける可能性が高いと考えられます。日本では2019年に初のCAR-T製剤キムリアⓇ(チサゲンレクルユーセル)が承認され、価格は約3,349万円(約30万ドル)に設定されました。
この高額な治療費にもかかわらずキムリアⓇは公的保険収載され、患者負担は高額療養費制度の範囲内に抑えられています(ただし医療財政への影響に配慮し、厚生労働省は費用対効果評価に基づく価格調整を行っています)。同様に、2021年保険適用となった第一三共のイエスカルタⓇ(アキシカブタゲンシロルユーセル)も高額なため費用対効果評価の対象となりました。
将来的にPRIME-CAR-T療法が承認された場合も、一度きりの投与で高い効果が期待できる治療であることから、公的保険適用は現実的でしょう。ただし対象患者数が固形がんでは血液がんに比べて格段に多い可能性があり、医療財政や保険償還へのインパクトは一層大きくなります。
そのため、日本では中央社会保険医療協議会での費用対効果評価や償還価格の慎重な設定が行われると予想されます。海外でも、米国では商業保険やメディケアでCAR-T療法の支払いがなされていますが、高額ゆえに支払いモデル(成果連動型契約など)の工夫が議論されています。PRIME-CAR-Tも高額な細胞医療となることが予想され、各国で保険者とメーカー間の価格交渉や支払いスキームの検討が重要になるでしょう。
医療経済的インパクト(コスト、医療資源、普及性など)
PRIME-CAR-T療法は、患者にとって画期的な治療となり得る一方で、医療経済への影響も無視できません。以下に主要な観点を整理します。
- 治療コストと費用対効果: CAR-T療法は患者自身の細胞を用いたオーダーメイド医療であり、製造に高度な設備と時間を要するため、一例あたり数千万円規模の費用が発生します。PRIME-CAR-T療法も追加の因子(IL-7/CCL19)を発現させる以外は基本的に自家CAR-Tと同様の製造工程を辿るため、現行のCAR-T製剤と同程度の高額医療になると考えられます。もっとも、従来治療が効かない進行がん患者にとって一度の投与で長期寛解や治癒が得られれば、長期的な医療費や介護費を削減できる可能性もあります。費用対効果の観点からは、高額でも延命効果やQOL改善によって十分価値を発揮するかが重要であり、その評価結果によって価格調整や公的支援の度合いが決まってくるでしょう。
- 医療資源・体制への影響: CAR-T療法の提供には細胞培養施設や専門知識を持つ医療スタッフが必要であり、一部の高度専門病院でのみ施行されています。固形がんへの適用範囲が広がれば対象患者数が増大するため、製造施設の増強や施療できる医療機関の拡大が求められます。副作用管理の体制も重要です。PRIME-CAR-Tでは副作用発生率が低下する傾向が報告されていますが、依然として重篤なCRSやICANS管理に備える必要があります。患者が治療を安全に受けられるよう、集中治療設備の整備や専門医の育成など医療資源の確保が課題となるでしょう。
- 普及性と技術開発によるコスト低減: 将来的により多くの患者に提供するには、製造コストの低減とスケールアップが鍵となります。現在は患者毎に細胞を作製する自家型(オートローグ)ですが、他人由来の万能細胞等を使った同種型(オールジェニック)CAR-Tの研究も進んでいます。ノイルイミューン社も再生医療ベンチャーと提携し、iPS細胞から作製した汎用T細胞にPRIME技術を適用する「同種PRIME-CAR-T」の研究を開始しました。このような技術が実現すれば、一度に大量のCAR-T細胞を作り置きして複数患者に供給できるため、製造コストの削減や迅速な治療開始が期待できます。また、自家型であっても自動培養装置の開発や遺伝子導入効率の向上により、1症例あたりのコストダウンや生産性向上が図られています。政府や民間の支援によって製造インフラが充実すれば、普及に伴う単価低減(スケールメリット)も見込めるでしょう。
- 患者・社会への経済的影響: 患者や家族の視点では、保険適用により直ちの自己負担は大幅軽減されるものの、公的財政から見れば高額治療の累積は国民医療費の増大要因となります。社会全体で治療コストを負担するに値するだけのベネフィット(治癒や長期生存の改善)が得られるか、エビデンスに基づく判断が必要です。医療経済学的には、質調整生存年(QALY)あたりの費用など指標で評価し、他の医療介入との優先度を比較検討することになります。さらに、固形がん患者が増える中でこの療法が標準治療化すれば、働き盛り世代のがん克服による生産性向上や介護負担軽減といった間接的な経済効果も期待できます。一方、治療を受けられるのは高度医療機関に限られるため、遠方からの患者の交通・宿泊費、仕事を休むことによる機会損失なども考慮が必要です。総合的に見て、PRIME-CAR-T療法の普及は患者の人生や社会に大きな便益をもたらす可能性がありますが、それを支える費用負担の在り方や医療提供体制整備が今後重要な課題となるでしょう。
おわりに
PRIME-CAR-T療法は、従来困難とされた固形がんにCAR-T細胞療法の恩恵をもたらす次世代プラットフォームとして大きな期待が寄せられています。IL-7とCCL19の力で腫瘍内に「ミニリンパ節」を作り出し、CAR-T細胞自身と患者の免疫を呼び覚ますという独創的なコンセプトは、前臨床から臨床初期まで有望な結果を示してきました。
もっとも、現時点ではまだ開発の途上であり、固形がんで安定した有効性を示すには更なる改良やデータ集積が必要です。幸いにも国内外で大手企業との協働や臨床試験が進んでおり、将来的な承認・実用化に向けた道筋は着実に整いつつあります。
医療者にとっては新たな治療選択肢として、患者・家族にとっては難治がん克服への希望として、本療法が一日も早く安全かつ効果的な形で提供されることが望まれます。そのためにも、引き続き研究開発の動向を注視し、エビデンスに基づく慎重な評価と体制整備を進めていくことが重要です。
参考文献
Lei et al.:Safety and Feasibility of Anti‑CD19 CAR‑T Cells Expressing Inducible IL‑7 and CCL19 in R/R LBCL(Immunology / Cell Discovery, 2024)